|
トップページ >主な研究成果
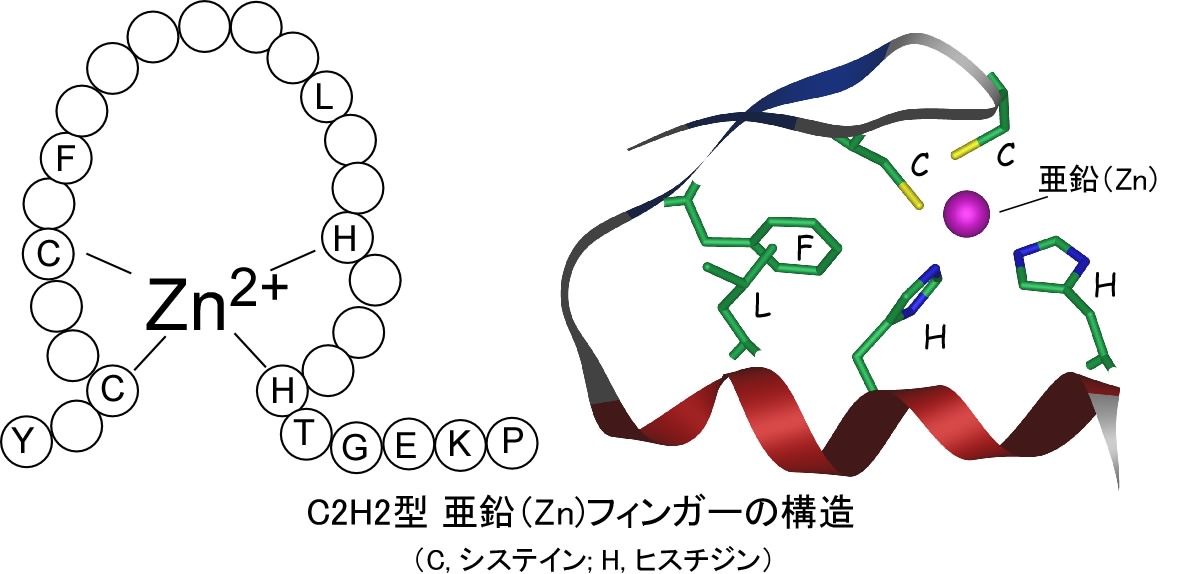
散在型核移行シグナルの構造決定 (Hatayama et al., 2008)亜鉛フィンガー(Znフィンガー)はタンパク質の中に比較的良く現れる構造です。そのうちC2H2型と呼ばれるものは2個のシステインと2個のヒスチジンが1個の亜鉛を取り囲み、全体として球状の構造を作っています(下図)。この構造はDNAと結合するタンパク質の部分にしばしば見いだされ、DNAの配列を認識して結合する能力を持ちます。多くの場合、DNAと結合するZnフィンガータンパク質は核に局在し、遺伝子DNAからmRNAが作られる過程(転写)を調節しており、脳が形づくられる過程でも重要な役割を果たしています。
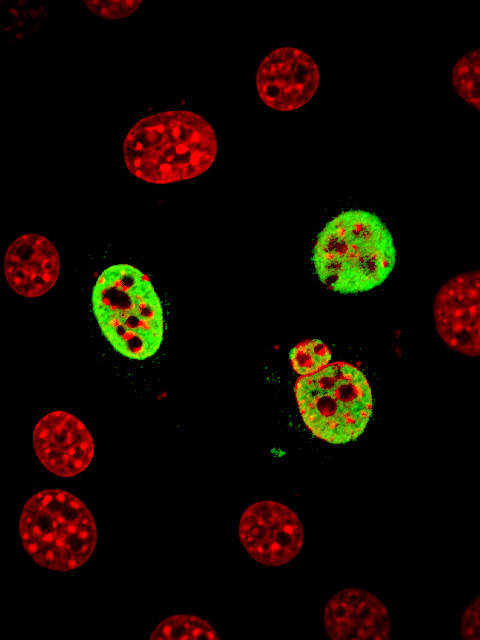
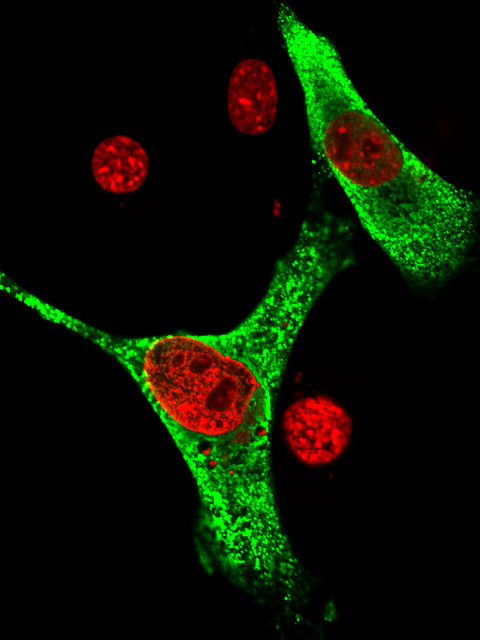
核にあるタンパク質の一部には「核移行シグナル」と呼ばれる部分があります。核移行シグナルはタンパク質を核に運ぶための宛先が書かれた荷札の役割を担います。核移行シグナルの構造はこれまでの研究から、リジン、アルギニンなどの塩基性のアミノ酸が数個連続している場合が知られており、これは古くから知られているので、「古典的核移行シグナル」と呼ばれています。一方、Znフィンガータンパク質の多くはこの古典的核移行シグナルを持っていないにも関わらず、核に運ばれていきます。何らかの核移行シグナルがあるはずですが、どのような形の核移行シグナルが、どこにあるのかわからない場合がほとんどでした。私たちの注目するZicタンパク質もそのようなZnフィンガータンパク質のひとつでした。Zicタンパク質は細胞の核で機能するタンパク質で動物の初期発生、神経の発生に重要な役割を果たします。 今回、私たちはZicの核移行シグナルの場所を明らかにし、Znフィンガー領域の中にある核移行シグナルの構造を決定することに成功しました。わたしたちはまず、Zicタンパク質をさまざまな部分に分割して、どこに核移行シグナルがあるかを探索し、その3次元構造を調べました。その結果、Znフィンガー領域の中に散らばっている塩基性アミノ酸がコンパクトに折りたたまれることで、2カ所に集中し、核移行シグナルの中心となる塩基性アミノ酸のかたまりを作ることを発見しました(動画:青と赤の部分が核移行シグナルを作る塩基性アミノ酸)。この場合、タンパク質が正しく折りたたまれたときに初めて、塩基性アミノ酸が集合するので、「散在型核移行シグナル」と呼ばれています。Zicの散在型核移行シグナルはタンパク質の3次元構造上、意外にも古典的核移行シグナルに似ており、実際にこの構造が核への運び役となるインポーチンというタンパク質と結合することが明らかになりました。 正常のZIC3 核移行シグナルを持たないZIC3 (緑はZIC3タンパク質の分布、赤は細胞の核の分布を示しています) Zicタンパク質の核移行の障害が心臓奇形の発症に関わることが最近明らかになりました。今回の私たちの発見は、この疾患の発症機序の理解に貢献することになるだろうと期待しています。
|