発達障害と社会的行動障害に関わるシナプス成熟促進タンパク質の発見
(Morimura et al., 2017)
- LRFN2欠損マウスは発達障害に類似する症状や記憶機能の向上を示す
- LRFN2は脳のグルタミン酸受容体などの分布を変えて、シナプスを成熟させる
- 発達障害患者から、LRFN2の機能を低下させる遺伝子変異が見つかった
私たちは神経細胞の膜に存在するタンパク質の「LRFN2[1]」が脳の発達に伴うシナプスの成熟に重要であることを発見しました。LRFN2欠損マウスでは、他者との接触を嫌う「社会的引きこもり」や、特定の行動に強いこだわりを示す傾向、強い音に対する驚き反応の異常などの症状を示しました。一方で、記憶の機能は向上していました。これらの症状は発達障害の患者によく見られるものであることから、LRFN2の遺伝子変異を探索したところ、自閉スペクトラム症などの患者の中にLRFN2の機能に異常をきたす遺伝子変異がみつかりました。詳細な解析でLRFN2はシナプスの中のグルタミン酸などの神経伝達物質を受け取る部位で、グルタミン酸受容体の位置を決める「PSD-95 [2]」タンパク質に結合して、受容体の量や記憶の基礎となるシナプスの性質(可塑性)を制御していることがわかりました。また、マウスの脳の中でLRFN2は海馬や大脳皮質に多く分布しており、発達の過程でLRFN2の量が増えていきますが、LRFN2が欠損するとシナプスの形が異常になり、幼若なシナプスのようになりました。
今回、LRFN2がグルタミン酸受容体の分布を制御することが、記憶機能の成り立ちに重要であることが示されたわけですが、我々のグループでは今後、社会性行動を担う脳の回路がどのようにつくられ、LRFN2がどのような役割を果たすのかについて詳しく調べる予定です。また類似した構造を持つシナプス膜タンパク質群についても研究を進めており[3]、脳の発達メカニズムの解明を目指します。 - 2017年6月12日プレス発表
脳には数多くの神経細胞(ニューロン)が存在して、複雑なネットワークが形成されています。神経細胞の間にはシナプスと呼ばれる構造があり(図1)、ここで一つの神経細胞から神経伝達物質が放出されて、別の神経細胞の細胞表面にある受容体に作用することで、情報の受け渡しが行われています。
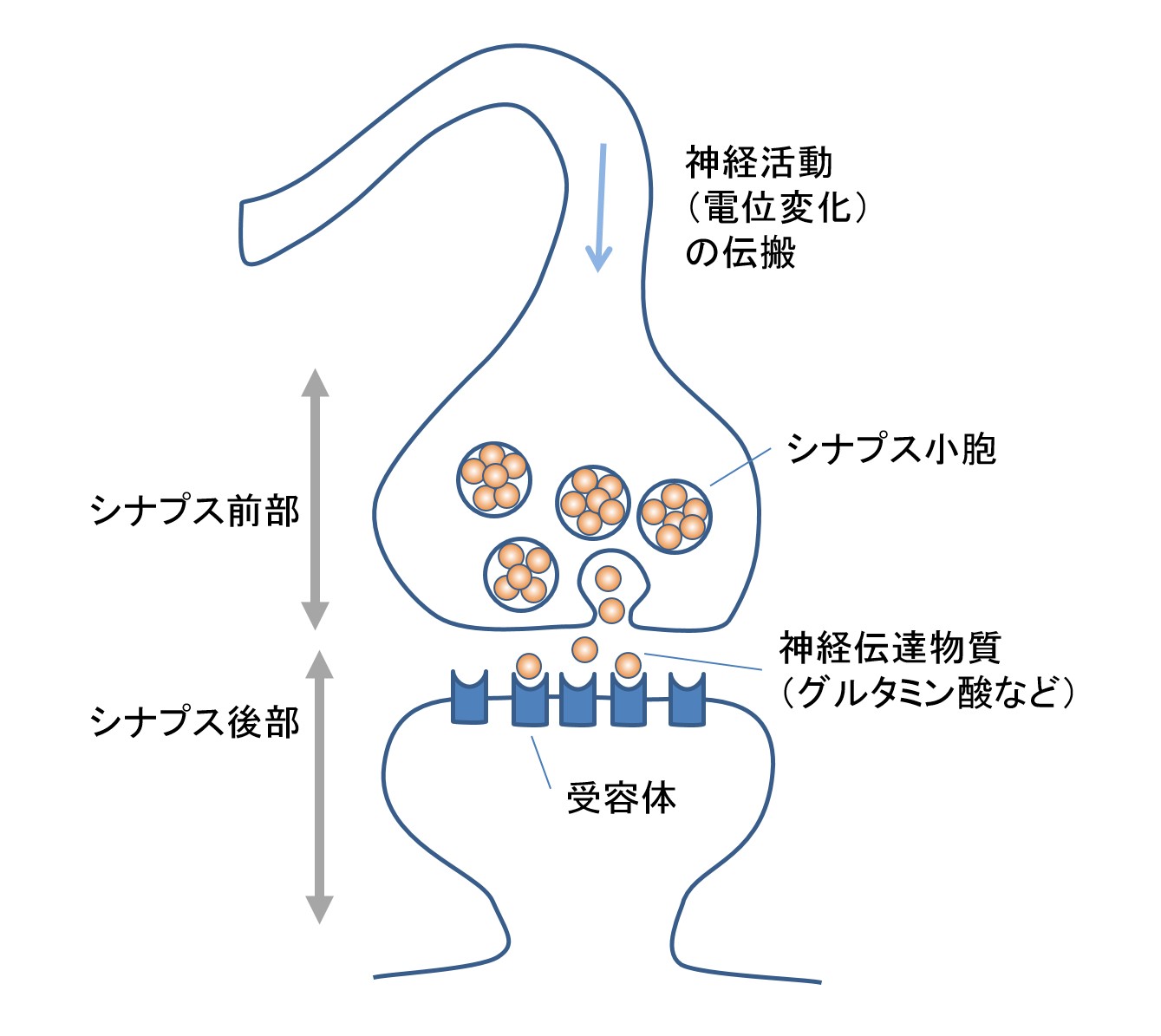
神経伝達物質はシナプスのうちシナプス前部と呼ばれる部分にある小胞に蓄えられていて、情報の受け手の神経細胞を興奮させる作用を持つものと抑制する作用を持つものがあります。このうち、脳の主な興奮性の神経伝達物質はグルタミン酸です。グルタミン酸受容体はシナプスのうちシナプス後部と呼ばれる細胞表面にあって、イオンの通り道を開閉するもの(イオンチャネル型)と細胞内の酵素の活性を調節するもの(代謝共役型)があります。このうち、イオンチャネル型にはNMDA型とAMPA型と呼ばれるものがあり、グルタミン酸が結合するとナトリウムイオンなどの陽イオンが細胞内に透過し、神経細胞が興奮します。これらのグルタミン酸受容体の分布の変化が、シナプスの活動状態などによってシナプス伝達の効率が変化する性質(シナプス可塑性)と関係するものと考えられています。これらのイオンチャネル型グルタミン酸受容体の分布を決める上で重要な役割を果たすことが知られているものに「シナプス足場タンパク質」があり、代表的なものは「PSD-95」です。シナプス後部には多くの細胞膜を貫通するタンパク質「シナプスオーガナイザー」(シナプス接着分子とも呼ばれる)が存在しており、このうちいくつかのものはPSD-95と結合して、PSD-95をシナプス後部に繋ぎ止める働きを持つことが知られています。
ヒトやマウスなど哺乳類の脳には海馬と呼ばれる構造があり、記憶の形成や想起に重要な役割を持つことが知られています。海馬の神経回路では生後の発達過程でシナプス後部のPSD-95の量が増え、それに伴ってシナプスの形態、機能が成熟していくことが知られていますが、どのシナプスオーガナイザーが生体内でこの役割を果たすのかが、不明でした。
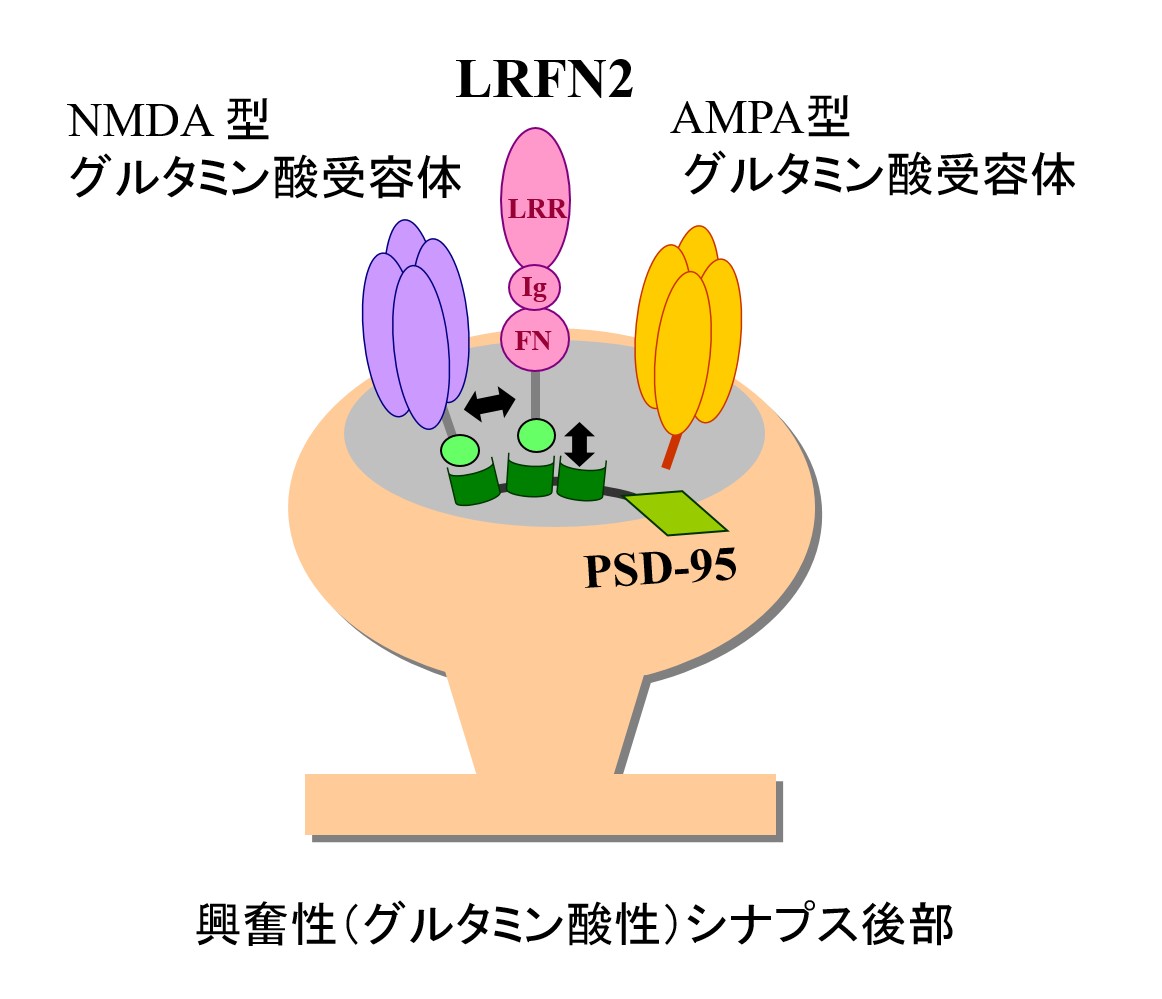
私たちは発達過程でシナプスの性質が決定される仕組みを調べるために、いまだ機能の分かっていないシナプスの膜タンパク質について研究を進めてきました[3]。今回の発見につながったLRFN2は1回膜貫通型のタンパク質で、いくつかの保存された構造をもっていて、細胞内にはPSD-95と結合する部位があります。このタンパク質は、興奮性神経細胞で作り出され、シナプスにも局在してPSD-95やNMDA受容体と結合することが知られています(図2)。
LRFN2の脳における役割を知るためにLRFN2欠損マウス(ノックアウトマウス)を作成しました。このマウスは単独で飼っていると正常マウスと同じ体重を示すのですが、集団で飼っていると正常マウスよりも体重が低くなります。このことから、我々はこのマウスの社会性に問題があるのではないかと考え、社会性行動を調べるいくつかの実験を行いました。
初めに単独で飼われていたLRFN2欠損マウスの飼育ケージ(かご)に見知らぬ新たなマウスを入れてやりました。正常のマウスでは、現れた新入りマウスに近寄り、調べたり、ケンカを仕掛けたりという行動が観察されます。しかし、LRFN2欠損マウスではそのような行動は少なく、床敷の下にもぐって逃避するという珍しい行動を見せ、新入りマウスとの接触を避ける様子が観察されました(図3)。また、マウスはヒトには聞こえない超音波を出して、他のマウスに働きかけることがありますが、その声を出す頻度もLRFN2欠損マウスでは減っており、音声によるコミュニケーションにも異変が生じていると思われます。
また、社会性行動の他にも興味深い異常が見つかってきました。マウスは回し車のついたケージに入れてやると、その中を好んで走ってかごを回転させます。LRFN2欠損マウスではこの回し車を回す運動をとてもたくさん行います(図3)。このように特定の行動に執着する傾向は自閉スペクトラム症の症状と重なります。一方、マウスに突然大きな音を聞くと体をビクッとさせて、驚く反応が見られます(人も同じように大きな音を突然聞くとビクッとしますね)。しかし、マウスでも人でも、大きな音の前にそれ自体では驚かないようなレベルの音を鳴らしてやると、驚きの程度が下がることが知られています(驚愕反応のプレパルス阻害と呼びます)。この反応がLRFN2欠損マウスでは低下していました(図3)。この阻害反応の低下はヒトでは発達障害、統合失調症を含めていくつかの精神疾患に共通して表れる症状の一つにあげられています。

さらに驚いたことに、LRFN2欠損マウスでは記憶力が良くなっていることがわかりました(図3)。それは、周囲の風景と迷路のゴールの位置との関係を覚える「空間記憶」と、ある場所に行くと嫌な刺激(電気刺激)がくるということを覚える「恐怖記憶」と呼ばれるものについてです。どちらの場合も、体験したことをその場所や自分の状況と結び付けて覚えておくことが必要なので、このような記憶を「エピソード記憶」と呼びます。
エピソード記憶を形成したり、引き出したり(想起したり)するのには、脳の海馬という領域が重要な役割を果たすことが知られています。我々は正常マウス脳でのLRFN2タンパク質の分布を調べたところ、海馬や大脳皮質のシナプスに多く分布し、特に海馬の生後発達の過程でLRFN2タンパク質の量が増加することを見いだしました。そこで、LRFN2欠損マウスの海馬のシナプスの性質を調べてみたところ、興奮性シナプス後部の足場タンパク質PSD-95の量が減っており、興奮性シナプス後部がある突起が細長くなっていることがわかりました(図4)。この突起はスパイン(棘突起)と呼ばれていていて、脳が発達していく過程で太く、短くなっていき、マッシュルームの様な形のものが増えることが知られています。
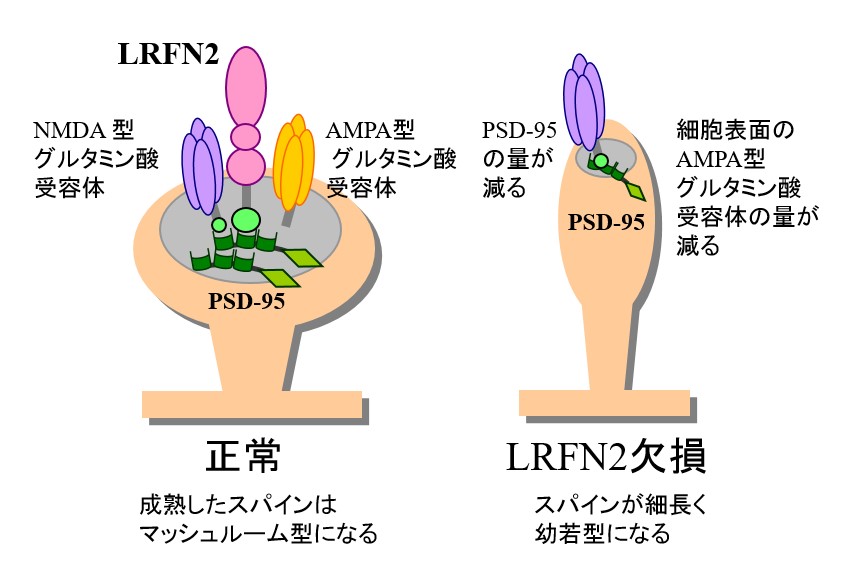
次にシナプスの働きがどのように変化するかを調べました。海馬の神経細胞に頻度の高い電気刺激を与えてやるとシナプスの伝達効率が上がった状態が長く続くことが知られています。この性質はシナプス伝達の長期増強(LTP)と呼ばれ、記憶の基礎になるものと考えられています。LRFN2欠損マウスのシナプス伝達の長期増強は正常マウスよりも上がっていました。つまり、可塑性が高いという訳です。最近の研究では海馬のCA1と呼ばれる領域のシナプス伝達の長期増強には、AMPA型のグルタミン酸受容体がシナプス後部の細胞膜表面に多く出てくることが密接に関係しているだろうと考えられています[4]。そこで、LRFN2欠損マウスのシナプス後部でAMPA型グルタミン酸受容体タンパク質の量を測ってみたところ、減っていることがわかりました(図4)。逆に培養した神経細胞に外からLRFN2遺伝子を投与してやり、LRFN2タンパク質を過剰に産生させてやると、表面にでてくるAMPA型グルタミン酸受容体タンパク質の量が増え、この働きにはLRFN2とPSD-95の結合が必要なことが示されました。これらの結果から、海馬が発達する過程でLRFN2がシナプスを成熟させるということがわかりました。
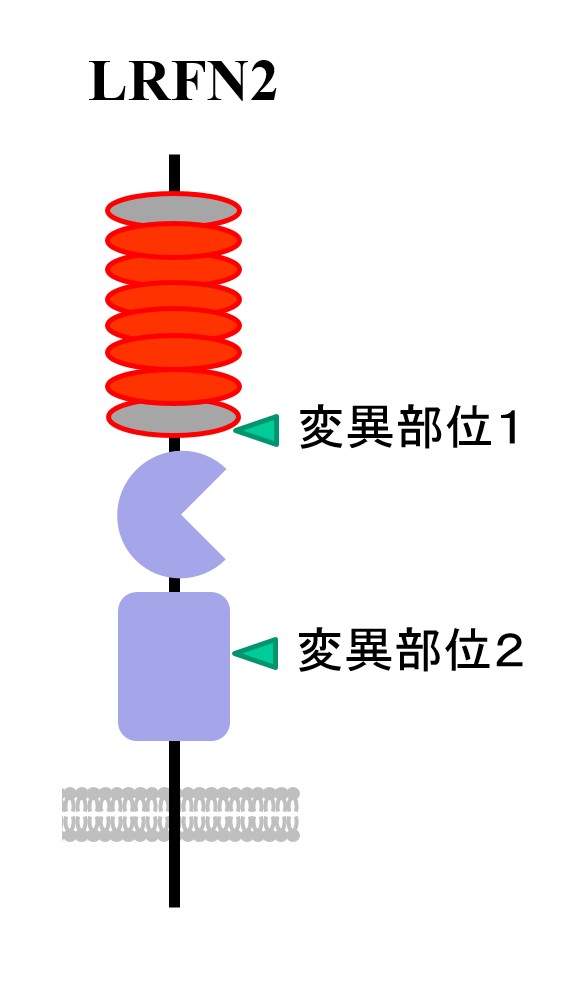
以上の結果から、私たちはマウスに現れた行動の異常が自閉スペクトラム症や統合失調症の患者さんの症状と似ていると考え、自閉スペクトラム症および統合失調症の患者さんを含む遺伝子材料を用いてLRFN2の遺伝子変異探索を行いました[5]。その結果、患者群にのみ認められるミスセンス変異(タンパク質の構造や機能に影響がでる遺伝子変異の一種)があることがわかりました(図5)。培養した海馬の神経細胞にLRFN2タンパク質、ミスセンス変異を持つLRFN2タンパク質を産生させて比較したところ、患者由来のミスセンス変異を持つLRFN2はPSD-95と結合する能力が下がることがわかりました。
以前に報告された家系研究や遺伝子関連研究で、ヒトのLRFN2を産生する遺伝子近傍の構造変化が学習障害、反社会性パーソナリティ障害へ関与する可能性が示されています[6]。今回の研究で明らかになったLRFN2欠損マウスの行動異常はこれらの報告にある患者の病態と何らかの関連があるのかもしれません。LRFN2の機能を更に解明すると共に、LRFN2欠損マウスでどのような機序で社会行動の異常がおきるのかを解明することが次の大きな課題となっています。脳の中で主要な神経伝達物質として働いているグルタミン酸ですが、グルタミン酸受容体を標的とした神経疾患の治療薬も登場しており、動物モデルを用いて分子レベルから脳の機能の異常を解き明かすことは、適切な治療薬の開発にもつながるものと考えています。
この研究は、理研脳科学総合研究センターの守村直子(現滋賀医大)、山口和彦、片山圭一(現和歌山医大)、富岡直子(現帝京大薬学部)、小田川摩耶、神谷明子、岩山佳美、前川素子、山田一之(現静岡産業大)、吉川武男、群馬大医学系研究科の安田浩樹、弘前大学医学部の中村和彦、福井大学子どものこころの発達研究センターの松崎秀夫、中京大学現代社会学部の辻井正次の各氏との共同研究として行われました。
補足説明
[1] LRFN2
ロイシンリッチリピート (LRR)とフィブロネクチン3 (FnIII)ドメインを持つ膜タンパク質。2006年に本研究グループと米国、韓国のグループにより報告された。SALM1とも呼ばれる。本研究グループではLRFN2の産生が特に生後の海馬の発達過程でが増加することに注目し、解析を続けてきた。LRFN2の分子機能として、PSD-95と結合すること、NMDA受容体と結合することが知られていた。
[2] PSD-95
興奮性(グルタミン酸性)シナプスのシナプス後部の足場タンパク質の一つ。NMDA型グルタミン酸受容体と直接に、AMPA型グルタミン酸受容体と他のタンパク質を介して、結合することが知られている。
[3] これまでの研究成果
- ./ra-tmok2014.html
- ./lcn/SLITRK6_myopia_deafness.html
- ./lcn/Slitrk3_inhibitorysynapse.html
- ./lcn/Katayama_Slitrk1.htm
[4] シナプス伝達の長期増強とAMPA型グルタミン酸受容体の分布変化
シナプス後部には表面で働くAMPA受容体以外にも、細胞内に予備のAMPA受容体があることが知られている。電気刺激の頻度が高いと、NMDA受容体を介して、カルシウムイオンが細胞内に流れこむようになる。これをきっかけとして予備のAMPA受容体も細胞表面に出て使われるようになる。AMPA受容体がシナプス後部の細胞表面に増えると、一定量のグルタミン酸(神経伝達物質)を受け取ったときに細胞内に流れこむナトリウムイオンの量が増える。そのため、神経細胞が興奮しやすくなり、シナプス伝達の効率が上がると考えられている。
[5] LRFN2の遺伝子変異探索
この研究では特にタンパク質機能の変化に注目して、健常群および患者群のLRFN2のタンパク質コード領域(アミノ酸配列に翻訳される領域)の遺伝子配列解析(re-sequencing analysis)を行っている。変異にはタンパク質の構造に変化を与えるもの(ミスセンス変異―アミノ酸の置換、ナンセンス変異―ストップコドンができる、フレームシフト変異―塩基の欠失挿入によりタンパク質の読み枠がずれる)とタンパク質の構造には変化が及ばないもの(サイレント変異)がある。自閉スペクトラム症患者の遺伝子材料の一部は、発達障害児者とその家族の当事者団体・NPO法人「アスペ・エルデの会」から提供を受けている。
[6] これまでのヒトLRFN2に関係する遺伝学的研究
- Thevenon, J. et al. Heterozygous deletion of the LRFN2 gene is associated with working memory deficits. Eur J Hum Genet, doi:10.1038/ejhg.2015.221 (2015)
第6染色体6p21領域の870 kbの欠失(LRFN2遺伝子を含む)が常染色体優性遺伝の学習障害(Learning deficiency)患者3人を含む1家系で見つかった。成人患者1名は長期記憶能力は平均値以上であるが、作業記憶能力、実行能力、聴覚情報処理能力に障害が認められた。 - Rautiainen, M. R. et al. Genome-wide association study of antisocial personality
disorder. Transl Psychiatry 6, e883 (2016).
フィンランドの犯罪者のうち反社会性パーソナリティ障害と診断された370人と一般人5850人を対象にしたゲノムワイド関連解析でLINC00951遺伝子とLRFN2遺伝子の間の領域に存在する2個の一塩基置換(多型)が反社会性パーソナリティ障害と強い相関を示した。


