|
トップページ >最近の研究成果
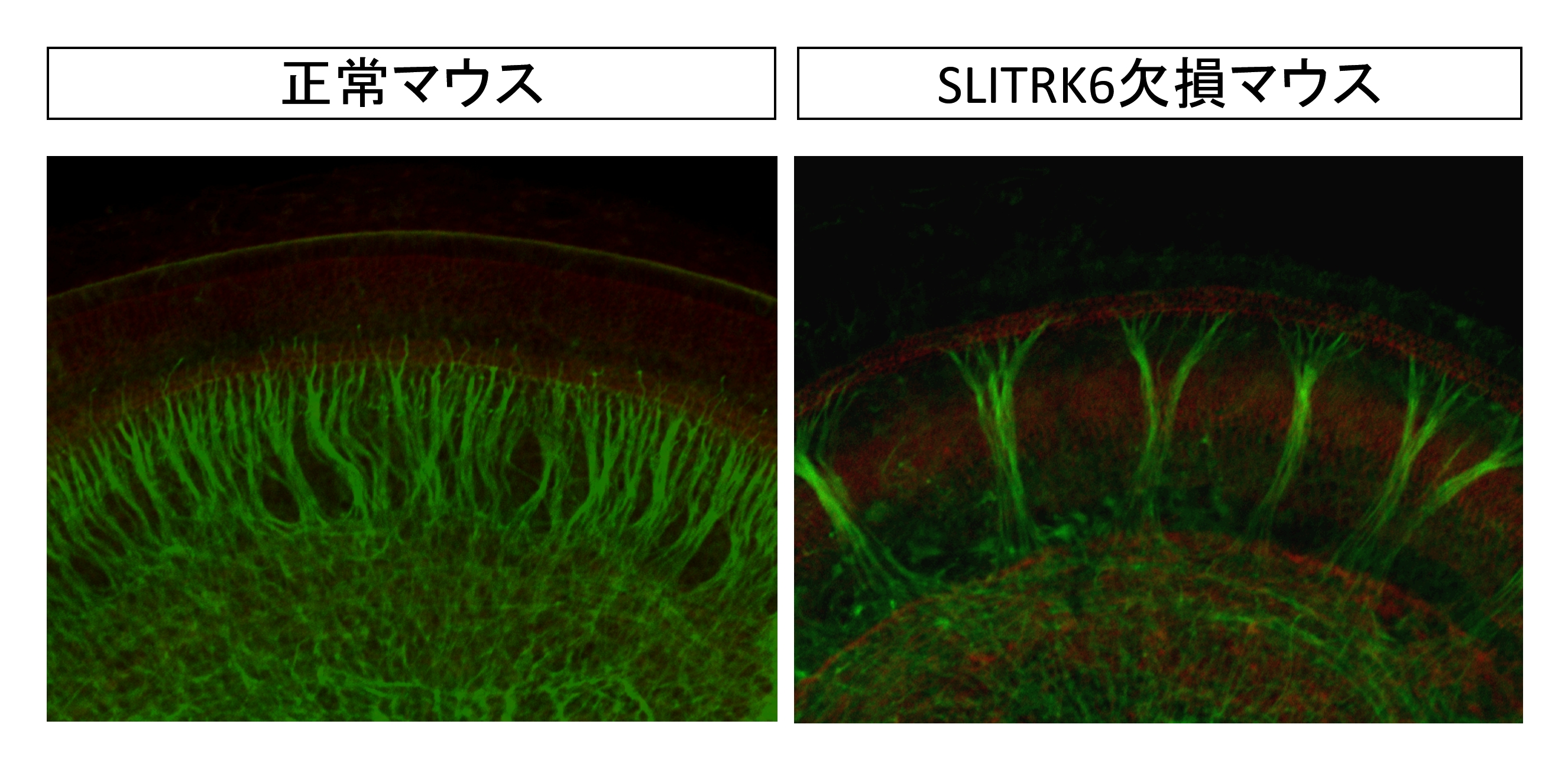
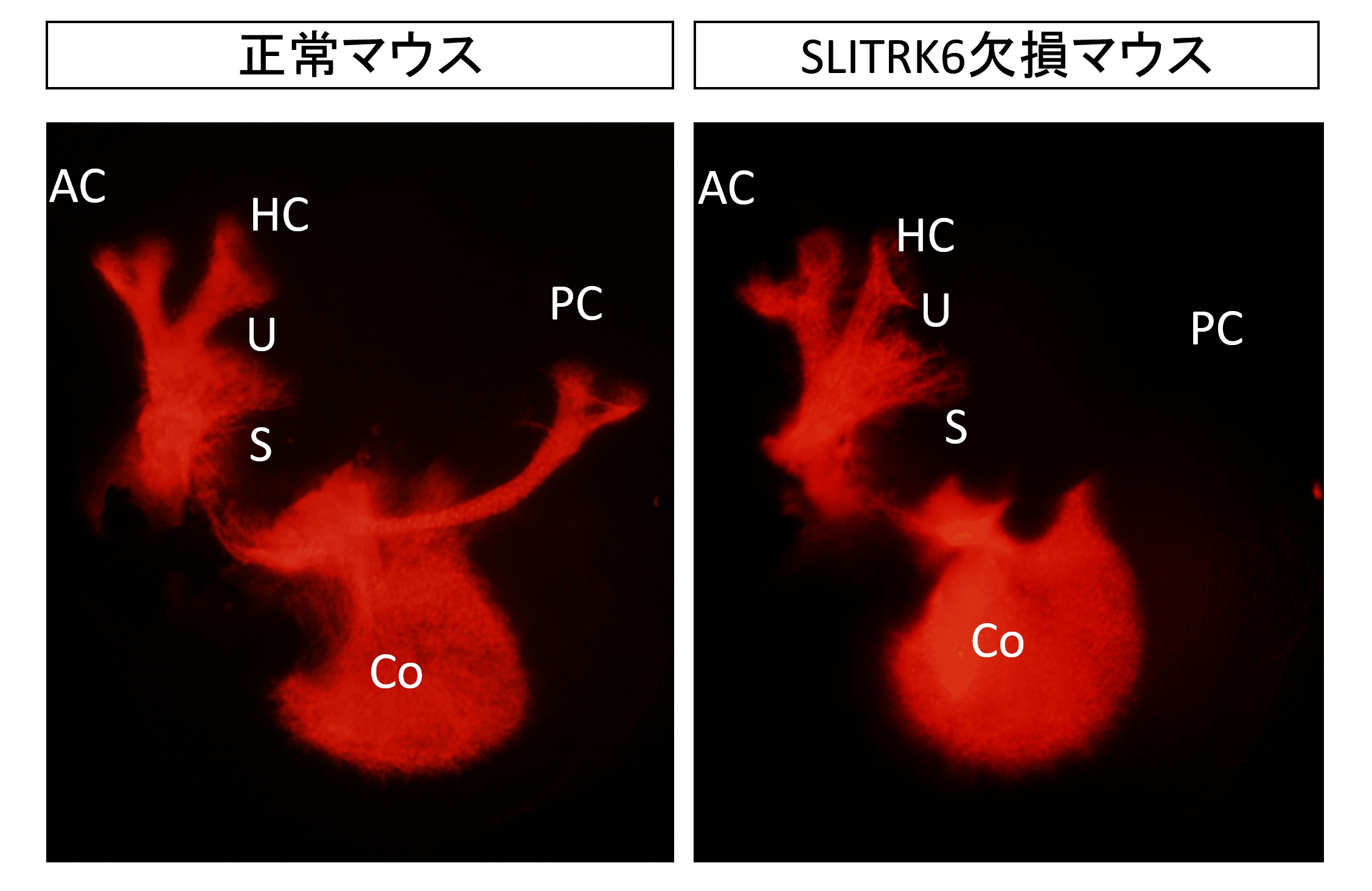
内耳の神経回路形成に重要な役割を持つ膜タンパク質「SLITRK6」を発見 (Katayama et al., 2009)私たちは2002年から、遺伝子情報のコンピュータ解析を基に、脳機能に重要な遺伝子を予測し、その遺伝子産物の機能を探る研究プロジェクトを進めてきました。その成果の1つとして、6種類の細胞膜貫通型タンパク質からなるSLITRKファミリーを見いだしました。SLITRKファミリーのうち、SLITRK1~SLITRK5が脳神経全体で広く発現するのに対し、SLITRK6タンパク質だけは内耳など脳以外の組織でも発現しています。また、SLITRK1タンパク質は、米国のグループがトゥレット症候群との関連を指摘しており、私たちも、SLITRK1欠損マウスで強い不安抑うつ傾向などの行動異常が認められることを報告しています(解説)。しかし、動物の発生過程におけるSLITRKファミリーの役割は、いまだ明らかになっていませんでした。 内耳は耳の最内部の器官で、聴覚にかかわる蝸牛、平衡感覚にかかわる前庭器官などが含まれています。これらの器官では、感覚上皮の中に存在している有毛細胞が感覚の情報を最初に受け取り、その情報を内耳の神経節にある神経細胞を介して脳へと伝えます。発生の過程では、感覚上皮に向かって、神経節からの神経突起が伸び、シナプスを形成することで、内耳の神経回路が形成されます。これまでの研究から、内耳の神経回路形成では、神経栄養物質ニューロトロフィンのうちBDNFとNTF3が重要な役割を持つことが知られていました。これらのニューロトロフィンやニューロトロフィン受容体を欠損したマウスでは、内耳の中にある神経細胞が正しく突起を伸ばすことができない、細胞死を起こしてしまう、などの異常が表れます。また、ニューロトロフィンを介した情報伝達系は内耳に限らず、神経細胞の成長、生存、シナプス伝達の調節などに多様な役割を持つことが知られています。 SLITRK6は、内耳の神経細胞が突起を伸ばしてシナプスを作る標的である感覚上皮という組織全体に存在しています。研究グループは、SLITRK6の役割を調べるために、ES細胞を用いた遺伝子相同組み換えにより、SLITRK6欠損マウスを作製し、内耳の異常を解析しました。その結果、このマウスでは、ラセン神経節から蝸牛の感覚上皮への神経突起の数が減少し(図1)、前庭神経節から前庭器官の一部である後半規管膨大部稜への投射がしばしば無くなる(図2)ことが明らかになりました。
図1 胎仔齢16日目の胚でのらせん神経節からの神経突起 正常マウスに比べ、SLITRK6欠損マウスでは、ラセン神経節から蝸牛の感覚上皮への神経突起(緑)の数が減少している。 (緑:ニューロフィラメントに対する免疫染色)
図2 胎仔齢13日目の胚での前庭神経節からの神経突起 正常マウスでは、前庭神経節から後半規管膨大部稜(PC)への投射が見られるが、SLITRK6欠損マウスでは見られない。蝸牛の神経節にはこの時期、まだはっきりとした異常が現れていない。 (AC:前半規管膨大部稜、Co:蝸牛、HC:水平半規管膨大部稜、U:卵形嚢、S:球形嚢)
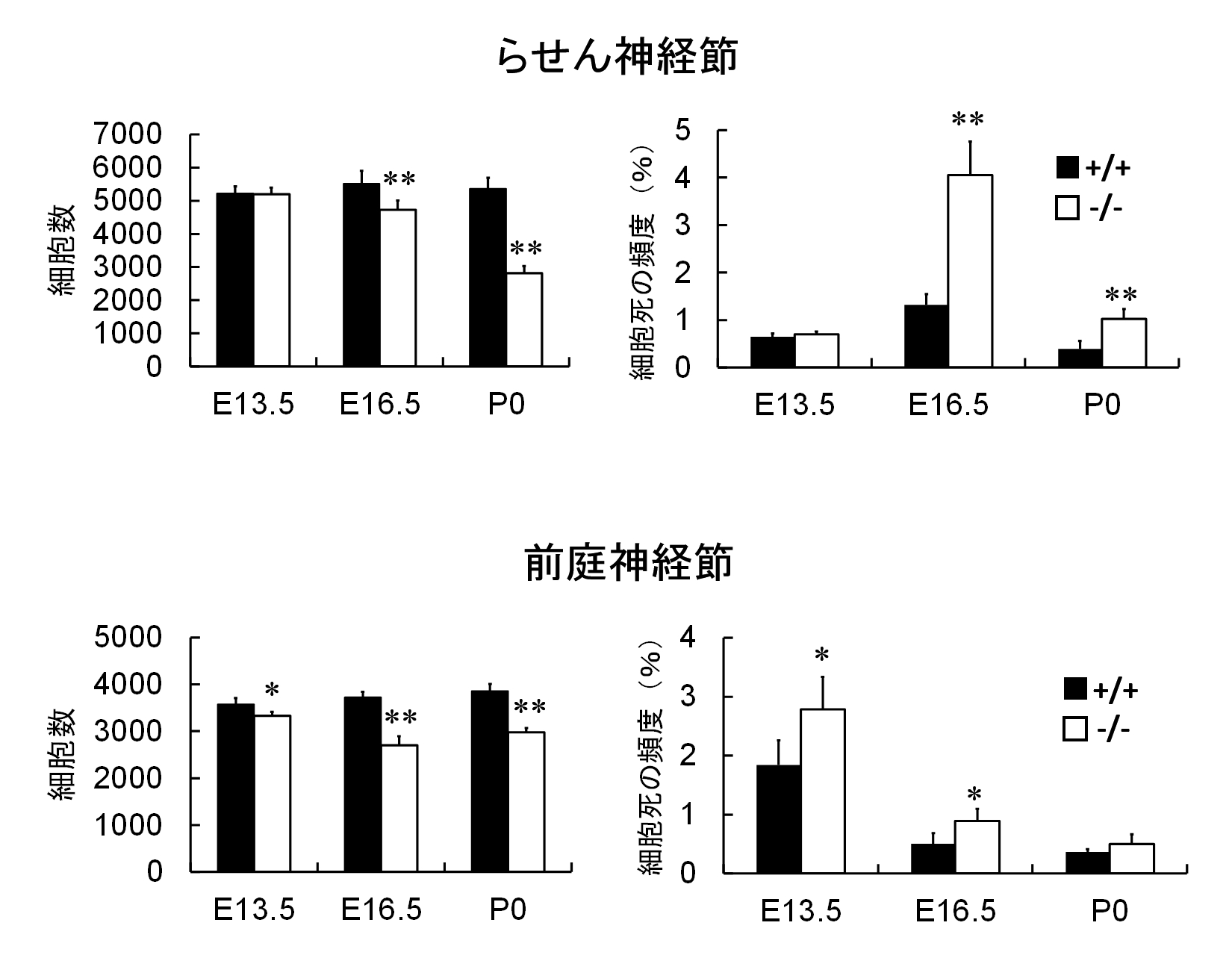
また、SLITRK6欠損マウスのいくつかの発生段階で、ラセン神経節や前庭神経節の細胞数を測定したところ、ラセン神経節では胎仔齢16日目から、前庭神経節では13日目から細胞数が減少し始め、それらの時期と一致して細胞死の頻度が増えていることが分かりました(図3)。
図3 正常マウス(黒棒)およびSLITRK6欠損マウス(白棒)におけるラセン神経節・前庭神経節の細胞数・細胞死の頻度の比較 ラセン神経節では胎仔齢16日目(E16.5)から、前庭神経節では胎仔齢13日目(E13.5)から細胞数が減少し始め、それらの時期と一致して細胞死の頻度が増えている。これらの細胞死のタイミングはそれぞれNTF3欠損マウス、BDNF欠損マウスで見られる細胞死のタイミングと一致している。ラセン神経節では細胞数減少が出生時(P0)まで続いている。
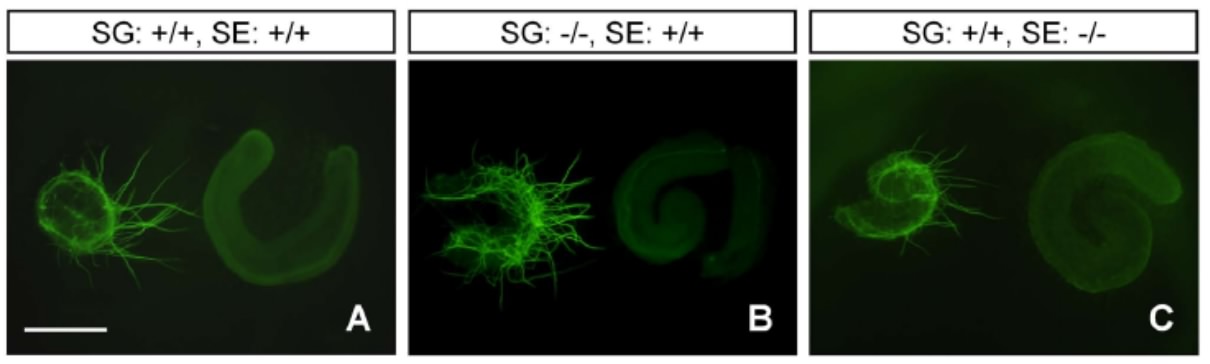
次に神経突起伸展の異常が、感覚上皮細胞、神経節細胞どちらの不具合によるものなのかを調べるために、正常あるいはSLITRK6欠損マウスから切り出した感覚上皮細胞・神経節細胞を組み合わせて培養皿の中で培養しました。その結果、SLITRK6欠損マウスの感覚上皮細胞は、正常マウスの感覚上皮細胞に比べて、神経突起伸展を促進する作用が弱いことが明らかになりました(図4)。
図4 正常マウス(+/+)およびSLITRK6欠損マウス(-/-)由来の ラセン神経節(SG)と蝸牛感覚上皮(SE)の同時培養 SLITRK6欠損マウス由来の蝸牛感覚上皮(SE)は、ラセン神経節(SG)からの神経突起伸展を促す作用が弱い(C)。
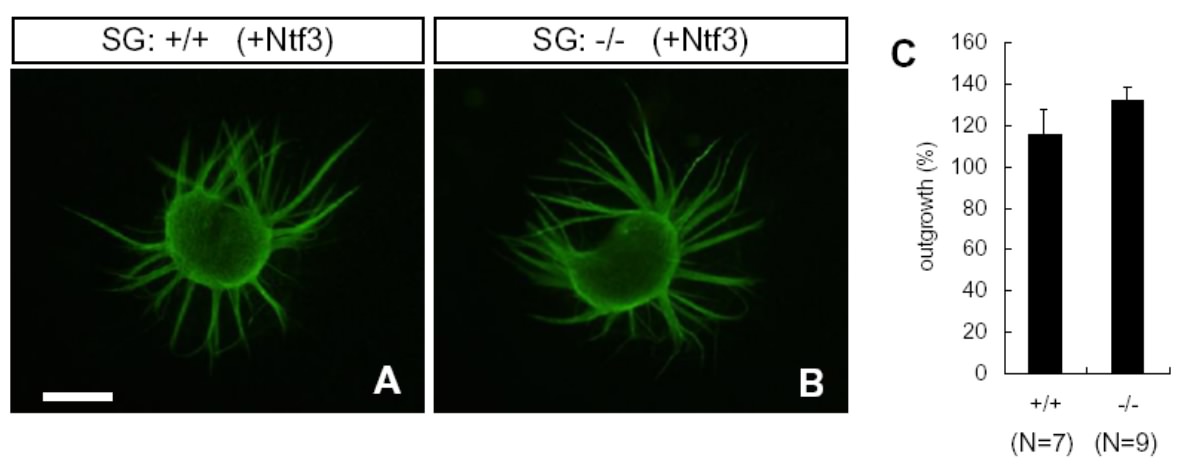
そこで、私たちは、神経突起伸展の異常は、感覚上皮細胞で発現する分泌性因子の減少が原因ではないかと考え、分泌性因子タンパク質であるニューロトロフィン(BDNF、NTF3)のメッセンジャーRNA(mRNA)量を定量しました。その結果、感覚上皮細胞におけるBDNF、NTF3の発現量はいずれも20%程度低下していることが明らかになりました。さらに、培養皿の培養液に外部からNTF3を添加し、正常およびSLITRK6欠損マウス由来のラセン神経節細胞を培養したところ、両者とも同じ程度の神経突起の伸展を示すことが分かりました(図5)。
図5 正常マウス(+/+)およびSLITRK6欠損マウス(-/-)由来のラセン神経節細胞(SG)のNTF3添加後の突起伸展 NtfTF3添加後は、正常マウス(+/+)とSLITRK6欠損マウス(-/-)との間で、ラセン神経節細胞の突起伸展に差は認められなかった(A, B)。 神経突起の成長を神経節のサイズを基準として比較したが、有意な違いは認められなかった(C)。
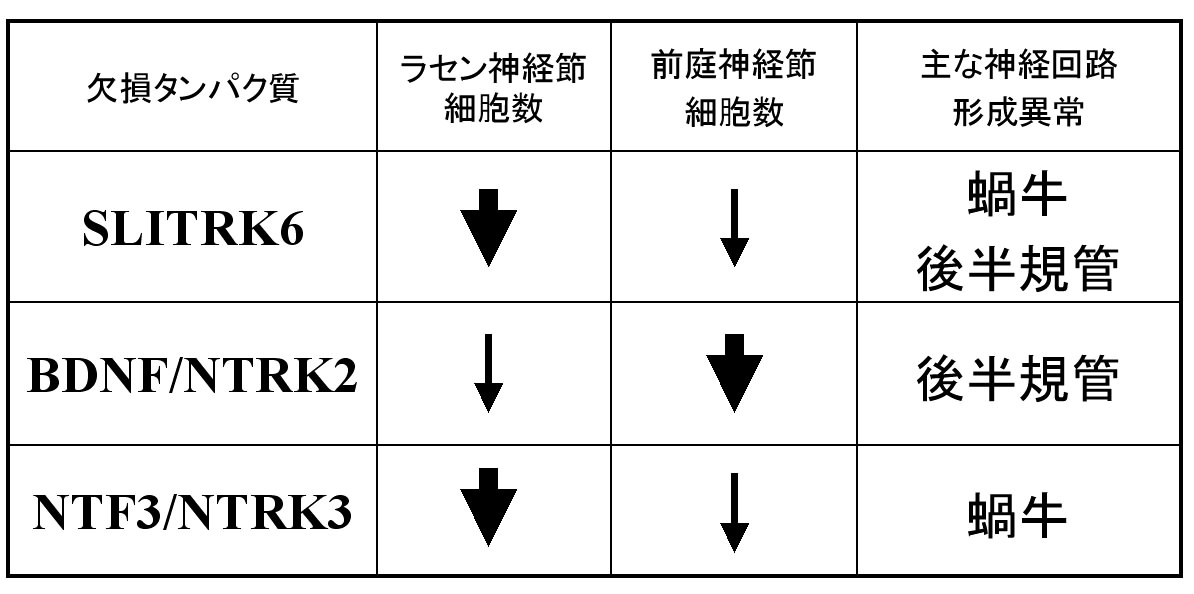
SLITRK6欠損マウスに表れた内耳の神経回路の異常は、ニューロトロフィン欠損による異常とよく似ています(表1)。このことと感覚上皮細胞におけるニューロトロフィンの発現低下から、SLITRK6欠損マウスに表れた内耳の神経回路形成の異常の少なくとも一部は、ニューロトロフィンを介した情報伝達の低下によるものと推測できます。
表1 SLITRK6欠損マウスと、ニューロトロフィン(BDNF、NTF3)またはその受容体(NTRK2、NTRK3)遺伝子欠損マウスに表れた内耳の異常の比較 細い矢印は弱い減少。太い矢印は強い減少を示している。SLITRK6欠損マウスに表れた異常は、BDNFまたはNTRK2欠損マウス、NTF3またはNTRK3欠損マウスに表れた異常の両方を併せ持っている。このことは、BDNFとNTF3が両方とも発現低下した結果と合致するものといえる。
私たちはこれまでに、SLITRK6変異マウスが難聴傾向を示すことを見いだしています。今後、SLITRK6の分子機能調節機構を解明することができると、感音性難聴の発症機構の理解や、治療法の改善に結びつくと考え、研究を進めています。同時に、今回見いだしたSLITRK6の機能は、いまだに不明な点の多いSLITRKファミリータンパク質の機能解明の突破口になることが期待できます。
<補足説明> 神経系に発現する新規の細胞膜貫通型タンパク質ファミリーとして、2003年理研脳科学総合研究センターの発生発達研究グループにより報告された1,2)。培養皿中ではニューロトロフィンの1つNGF がPC12細胞の突起伸展を促す過程に影響を与えることが知られていた。一個の膜貫通領域を持つタンパク質で、アミノ末端側にはロイシンリッチリピートというタンパク質-タンパク質間の結合によく用いられるドメインが2個存在し、カルボキシ末端側にはニューロトロフィン受容体と部分的に類似のアミノ酸配列が存在する。SLITRK6は脳の視床の一部、内耳の感覚上皮、舌、嗅上皮などでも発現していることが知られており3)、感覚受容に関連した機能を持つのではないかと推測されていた。 1) Aruga, J., Mikoshiba, K.: Identification and characterization of Slitrk, a novel neruonal transmembrane protein family controlling neurite outgrowth. Mol. Cell. Neurosci. 24, 117-129. (2003) 2) Aruga, J., Yokota, N., Mikoshiba, K.: Human SLITRK family genes, genomic organization and expression profiling in normal brain and brain tumor tissue. Gene 315, 87-94 (2003) 3) Aruga, J.: Slitrk6 expression profile in the mouse embryo and its relationship to that of Nlrr3. Gene Expr. Patterns 3, 727-733. (2003)
※2 ニューロトロフィン(神経栄養物質)、BDNF、NTF3、ニューロトロフィン受容体 ほ乳類の主なニューロトロフィン(神経栄養物質)として、NGF、BDNF、NTF3、NTF4 (NTF5とも呼ばれる)が知られている。これらは中枢神経系、末梢神経系あるいはその標的組織に幅広く発現している。これらのうちBDNF、NTF3は内耳での発現が強く、BDNFは主に前庭の神経回路形成に働き、NTF3は主に蝸牛の神経回路形成に働くものと考えられている。ニューロトロフィン受容体のうちNTRK2はBDNFのシグナルを受け取り、NTRK3はNTF3のシグナルを受け取ることが知られている。BDNF欠損マウスとNTRK2欠損マウス、NTF3欠損マウスとNTRK3欠損マウスに表れた内耳の異常は、それぞれ非常によく似ている。 外界からの刺激を受容し、さらに刺激を神経系に伝える機能を持つ上皮の組織。内耳の感覚上皮の他ほかに、嗅上皮や網膜なども含まれる。内耳の感覚上皮は、蝸牛ではカタツムリ型の管の中に細長い帯のような形をして1カ所に存在しており、前庭器官では卵形嚢と球形嚢にあるそれぞれ1つずつある斑、三半規管にそれぞれ1つずつあるある後半規管?膨大部稜の計5カ所にある。内耳の感覚上皮には有毛細胞と支持細胞が存在している。有毛細胞と支持細胞には共通の幹細胞があり、支持細胞の幹細胞が有毛細胞に分化できることが知られている。SLITRK6は内耳の感覚上皮全体に検出されるが、新生仔では支持細胞に強く分布している。 内耳もしくはそれ以降のに発達する?の聴覚経路神経系の障害に起因する難聴。感覚神経性難聴ともいう。原因としては遺伝子変異、ウイルス感染、薬物、音響外傷、加齢、聴神経腫瘍などがある。小さい音が聞こえない、話し言葉がわ分かりにくい、大きな音がやかましい、聞きたい音が聞きにくいなどの症状がある。最近の論文ではマウスを使った遺伝子治療の試みも報告されている1)。 1) Gubbels SP, Woessner DW, Mitchell JC, Ricci AJ, Brigande JV.: Functional auditory hair cells produced in the mammalian cochlea by in utero gene transfer. Nature 455, 537-541 (2008) 有毛細胞には特殊な繊毛が生えていて、音や頭の回転運動(角加速度)、直線運動(直線加速度)によりこの繊毛にゆがみが生じ、それが有毛細胞の中で電気信号に置き換えられる。有毛細胞は感覚上皮の中に存在している。 有毛細胞でとらえられた聴覚、頭の加速度に関する感覚は、まず内耳の神経節にある神経細胞で受け取られて、中枢神経系の聴覚、平衡感覚をつかさどる領域に伝えられる。内耳の神経節は大きくラセン神経節と前庭神経節に分けられる。ラセン神経節は蝸牛の有毛細胞からの情報を受け取り、前庭神経節は前庭器官の有毛細胞からの情報を受け取る。
|