- トップページ <
- 研究概要
研究概要
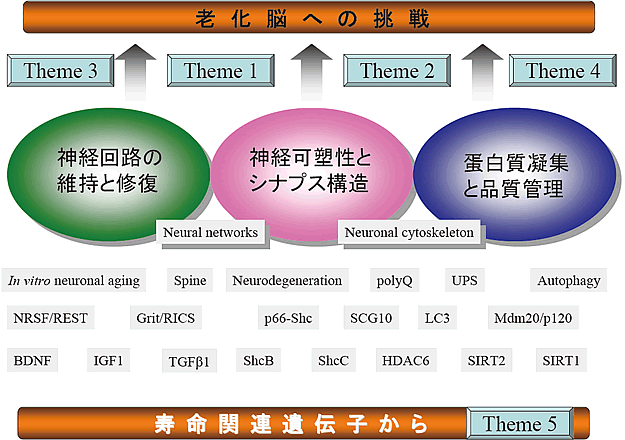
老化脳を守るためには「神経回路の維持と修復」「神経可塑性とシナプス構造」「蛋白質凝集と品質管理」の研究が重要です。私たちは、これを柱に、寿命遺伝子の視点も加えて、5つの研究テーマからアプローチしています(下図参照)。
私たちの研究成果はこれまでにこの領域の専門誌の表紙を飾っています。
 |
 |
 |
 |
|||
| 1988 | 2005 | 2006 | 2008 |
次のニュースはいつ誰が作るのでしょう?それを楽しみに日々の研究を見守っていきます。
脳の老化というとアルツハイマー病が頻繁に議論されます。しかし、脳は生理的な老化とともに学習記憶能力が減退していきます。その根本原因は脳の海馬の神経細胞の可塑性低下にあります。私たちは神経特異的なシグナル伝達分子で海馬神経での活動性や可塑性に関わるN-Shc/ShcCを同定し、その機能解析を進めてきました。N-Shc遺伝子欠損マウスは学習記憶能力が亢進しますが、N-Shcは神経の機能的可塑性に関わるだけでなく海馬神経の構造可塑性にも深く関わることがわかりつつあります。Shc系分子は植物にはなく、神経や筋肉をもつ動物で進化した遺伝子です。私たちはこの動物特有のシグナル分子の働きから老化脳での学習記憶能力の低下の分子機構を解き明かそうとしています。
Further Reading:
●森:Shcシグナリングからみる寿命制御と老化脳保護、生化学 78 (3), 189-200 (2006)
●Mori N and Mori M, Neuronal Shc: A gene of longevity in the brain? Med. Hypothes. 77, 996-999 (2011)
脳が老化すると神経の活動性や可塑性が低下する。これはほぼ周知の事実ですが、私たちは、最近、小脳のプルキンエ細胞へのシナプスの可塑性が老化で極度に減退することを見出しました。さらに、このプルキンエシナプスの可塑性は幼若脳でも酸化ストレスを与えるとあたかも老化脳のように低くなってきます。酸化ストレスが神経可塑性減退の主因となっているように思えるのです。酸化ストレスは通常、種々の蛋白質のシステイン残基の SH 基を攻撃しますが、実際に若いマウスと老化マウスの小脳の蛋白質の SH基の量を比較すると、老化脳ではその多くが(酸化によって)ブロックされていることが明らかとなりました。老化による機能低下にはいろいろな理由がありますが、酸化ストレスは神経系の機能低下の大きな要素であることを示したわけです。
Further Reading:
●森、柿澤:老化脳 Clinical Neurosceince, 29 (7), 811-815 (2011)
脳の中の神経細胞(ニューロン)は生体組織の中でいわゆる非分裂細胞で、寿命の最も長い細胞です。したがって、一人の人間のような生物個体の老化を考えると生体内で最も年老いた細胞であるということができます。私たちはこの数年の間に、脳の海馬の神経細胞をシャーレの中で非常に長く培養する系をほぼ確立してきました。海馬のニューロンは培養後1~2週間で突起を伸ばし、3~4週間でシナプスを形成し、シャーレの中で複雑な神経回路を発達させます。このようにほぼ1ヶ月で成熟した神経のネットワークはその後も維持し続けることができ、4~5ヶ月で明らかな老化の兆候を示し、7~8ヶ月では神経変性様の形態をとることもわかってきました。私たちはこのインビトロの長期培養系を使って、神経老化のしくみの検討を始めました。その過程で、従来、重要視されていたNGFやBDNFのような神経栄養因子(ニューロトロフィン)とは別にある種の成長因子が老化神経の保護育成に重要な働きをしていることを見出しています。その因子があれば酸化ストレス下のニューロンの突起の損傷をも阻止できることも明らかになりつつあります。老化神経を守る新たな因子とその仕組みの解明が今進んでいます。
アセチル化関連分子からのアプローチ
最近、SIRT1というヒストン脱アセチル化酵素が老化制御の重要な因子として知られてきています。一方で、HDAC6という別のヒストン脱アセチル化酵素は細胞内の蛋白質凝集物の排除機構に重要と考えられるようになっています。私たちはこの知見を元に、生体内での寿命が最も長い神経細胞(脳の中のニューロン)の恒常性維持に関して、このようなアセチル化関連分子が何か大切な働きをしているのではないかと考え、老若脳や長期培養神経細胞での蛋白質凝集体や老廃物除去への関与を調べています。Mdm20/p120という従来あまり注目されていなかった蛋白質合成過程でのアセチル化関連分子も含めて、老若の神経細胞内でのオートファジーやユビキチンプロテアソームシステム(UPS)の活動性への影響を探索しています。
地球上に生息するさまざまな動物に寿命があるように、人間の最長寿命はほぼ120年。これは生物学的に、あるいは遺伝子によって決定づけられていると考えられています。寿命を制御する遺伝子がある。この事実はここ20年ほどの間に明確になってきました。では、寿命はどの臓器で制御されるか?おそらくは脳、それも視床下部が最も重要ではないかと考えています。しかし、一方で集団化社会の中では個々の動物の認知能力も運動制禦能力も生存への大きな力になります。したがって、脳全体の活動性が寿命に関わっていると考えてもあながち間違いではないでしょう。実験的にはなかなか切り込める状況にはありませんが、脳で発現している寿命遺伝子から脳の老化や生物の寿命制御のしくみを考察しています。
Further Reading:
●Mori N and Mori M, Quest for a long life: Paradoxes and essentials of evolving longevity 56, 73-80 (2011)
●森:脳の中の寿命遺伝子、理科大フォーラム 312, 7-13 (2010)
●森:寿命の進化史と遺伝子、エコソフィア 19, 17-24 (2007)
●森:遺伝子が解き明かす生と死のシナリオ、ニュートン別冊「知っているようで知らない人体の秘密」(2006)
●森:生物の生存戦略と寿命制御の遺伝子背景、(特集)「寿命」、科学 74 (12)1398-1402(2004)
●森:脳の老化と寿命制御、わかる実験医学シリーズ「老化研究がわかる」107-113(2002)