モルヒネを繰り返し投与したときに起きる鎮痛作用の減弱に関わる分子を発見
Fujita et al., Biomolecules (2022)
生体内には数百種類のGタンパク質共役型受容体(GPCR)が存在し、ホルモンや神経伝達物質などが結合して作用することが知られています。Gタンパク質共役型受容体は、数多くの医薬品の治療標的分子になっており、医学的にも非常に重要です。Gタンパク質共役型受容体が正しく働くためには、遺伝子情報を基に受容体タンパク質が合成されたのちに正確に折り畳まれ、多くの場合、細胞表面へ輸送される必要があります。この「受容体輸送」に関わるタンパク質群(受容体輸送タンパク質, シャペロンタンパク質)の一つとして、Receptor transporter protein (RTP) が知られています。私たちは、これまでに RTPがどのように脳神経系の機能と関わるのかについて研究を進めてきました。今回、鎮痛薬のモルヒネが働きかけるオピオイド受容体(Gタンパク質共役型受容体の1グループ)とRTPの関係について調べました。
RTP には RTP1からRTP4 の4種類ありますが、脳内で最も多いのは RTP4 です。私たちと共同研究者は、この RTP4 が、一部のオピオイド受容体の成熟化に関わることを報告してきました。すなわち、mu オピオイド受容体(MOPr)および delta オピオイド受容体(DOPr)の二種類のオピオイド受容体から形成される、MOPr-DOPr ヘテロ二量体の合成や成熟に、RTP4 が関与すると提唱してきました(Fujita et al., 2019; Decaillot et al., 2008)。直近の研究成果として、細胞培養を用いた実験では、長期的な MOPr の刺激ののちに、RTP4 が遺伝子誘導されるとともに、RTP4 を介して、内在性の MOPr-DOPr ヘテロ二量体の形成量と細胞膜発現が増加することを報告しています。一方、動物個体を用いた実験では、モルヒネの反復投与によって、視床下部の RTP 4 の遺伝子発現レベルが有意に増加することも明らかにしました(Fujita et al., 2019)。
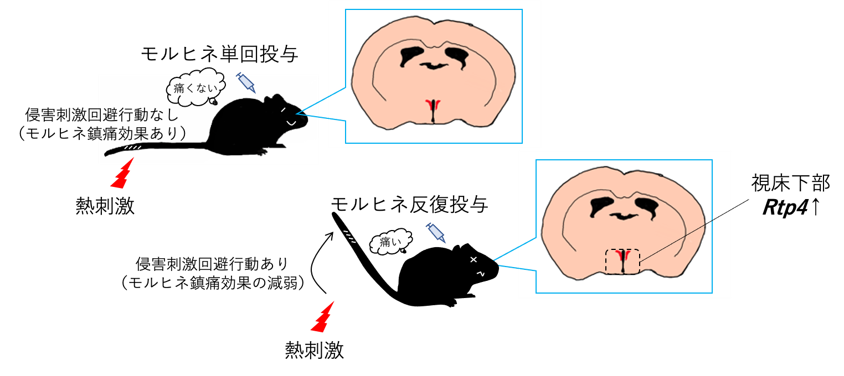
今回、この「MOPr の刺激によるRTP4を介するMOPr-DOPr ヘテロ二量体の形成量と細胞膜発現」の病態・生理的役割の解明のひとつとして、「モルヒネ反復投与によって生じる鎮痛耐性形成」への関与に注目しました。
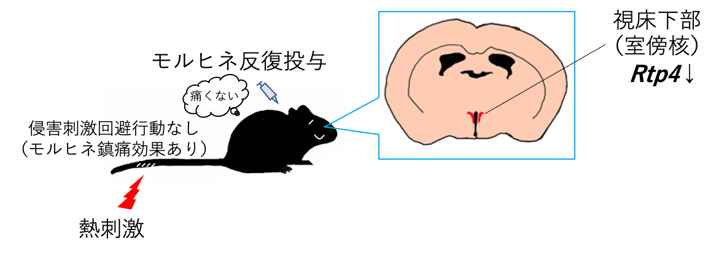
麻薬性鎮痛薬の一つであるモルヒネは、マウスに10 mg/kg の用量で皮下投与すると、Tail-flick 法による行動解析で、120分持続する鎮痛効果が確認できます。しかしながら、1日1回、10日間反復投与することにより8日目以降では、その鎮痛効果が有意に減弱しました(鎮痛耐性の形成)。前述したように、モルヒネの反復投与後の脳内では、視床下部においてのみ、RTP4 の遺伝子発現レベルが有意に増加することがわかっています。そこで今回、視床下部(特に室傍核)の RTP4 を特異的に欠損させたマウスを用いることで、このモルヒネ鎮痛耐性形成がどのように影響を受けるかを行動薬理学的に解析しました。
その結果、RTP4 を欠損させていないマウスでも、RTP4 を欠損させたマウスでも、モルヒネ反復投与の 8日目以降で、初日と比較して有意な鎮痛効果の減弱が生じました。しかしながら、11日目の鎮痛効果は、RTP4 を欠損させたマウスの方が有意に高く維持されていることがわかりました。このように、部分的ではありますが、RTP4 の欠損によって、モルヒネ鎮痛耐性形成の程度が緩やかになったことから、視床下部の RTP4 がモルヒネ鎮痛耐性形成の発現機序に関わっている可能性が考えられます。
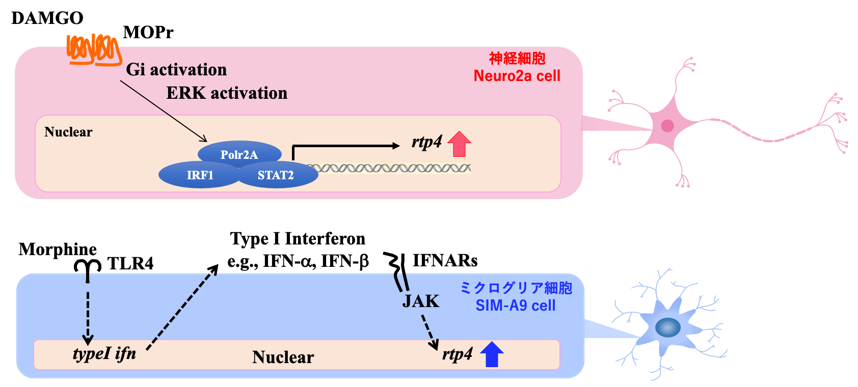
さて、モルヒネの反復投与によって、脳内の RTP4 の遺伝子発現レベルが増加することを前述しました。さらに私たちは、脳内のどのような細胞でRTP4 が発現誘導されるのか?という問に答えるため、モルヒネ鎮痛耐性形成への関与がわかっている、神経細胞とミクログリア細胞の役割に注目し、in vitro での解析を行いました。具体的には、神経細胞の株化細胞(Neuro2a 細胞)と ミクログリア細胞の株化細胞(SIM-A9細胞)を用い、それぞれの培養皿の中で、MOPr の刺激薬を添加することで、各細胞のRTP4 の遺伝子発現がどのように影響を受けるかを解析しました。
その結果、神経細胞では、μM オーダーの MOPr リガンド(DAMGO) による MOPr の活性化の下流で、 Gi タンパク質や MAPK の活性化経路を介して RTP4 の遺伝子転写が促進されることがわかりました。その一方で、ミクログリア細胞では、より高濃度、mM オーダーの MOPr リガンド(Morphine) が、MOPr ではなく、Toll 様受容体(TLR4)を活性化し、その結果、RTP4 の遺伝子誘導を促すことが示唆されました。過去の先行研究から、高濃度のモルヒネは、ミクログリア細胞では TLR 4に結合しうることがわかっていますが、本研究結果もそれらの知見と一致するものです。
加えて別の実験では、このミクログリア細胞において、TLR4 の下流でインターフェロンの誘導が生じることも見出しています(未発表データ)。実は RTP4 は、インターフェロン誘導性の遺伝子(Interferon-stimulated gene)の一つであることから、ミクログリア細胞では、インターフェロンを介した間接的な RTP4 誘導が生じている可能性が考えられます。
以上のことから、視床下部に存在している RTP4 がモルヒネを繰り返し投与したときに起きる鎮痛耐性の形成に関わることがわかりました。さらに、神経細胞とミクログリア細胞では、お互いに異なったメカニズムでモルヒネがRTP4の産生を増やすことも明らかにできました。
より詳細なRTP4 の働き方についてはまだ解決すべき点が残されています。たとえば、鎮痛耐性を形成する際に、実際にMOPr-DOPr ヘテロ二量体が増えているかどうか、RTP4 とMOPr-DOPr ヘテロ二量体がどのように相互作用するのか、RTP4 が どのようにMOPr-DOPr ヘテロ二量体の細胞膜移行性を高めるのか、などです。これらの点を解決することが、よりよい痛みの治療法の開発につながるのではないかと期待しています。


