てんかんや多動症の発症に関わる新たなシナプス制御メカニズムの発見
(Tomioka et al., 2014)
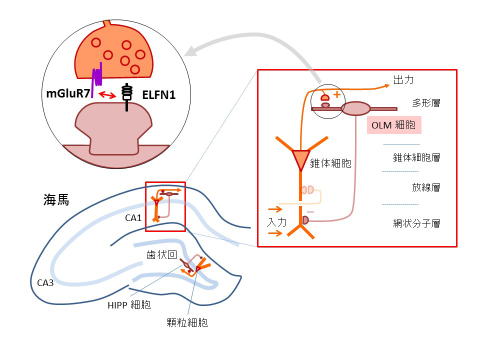
私たちは海馬の抑制性ニューロンに発現する後シナプス膜タンパク質の1つELFN1 *1が、代謝共役型グルタミン酸受容体の一つmGluR7 *2に結合して前シナプスへの集積を引き起こし、抑制性ニューロンのシナプス可塑性を制御していることを発見しました。作製したELFN1欠損マウスの行動を観察したところ、ヒトに触られるとてんかんのようなけいれん発作を示し、多動や警戒心の低下などの行動異常があること、また、脳波をとってみると振幅の大きな異常な波が頻発することがわかり、ELFN1欠損マウスでは脳の過活動が生じているのではないかと予想されました。研究グループはさらに、てんかんおよび多動症の患者さんのDNAを用いてELFN1の遺伝子変異を調べたところ、ELFN1の機能を損なう変異が一部の領域に集中して存在していることを発見しました。これらのことから、ELFN1は抑制性ニューロンへの適切なシナプス入力に不可欠のものであり、この遺伝子の変異がてんかん・多動症のような脳の興奮抑制バランスの乱れを背景とした病態に関係する可能性が示されました。 今回、ELFN1がグルタミン酸受容体の分布を制御することが、脳の機能に重要であることが示されたわけですが、研究グループでは今後、ELFN1がmGluR7以外にどのような分子と関係を持つのか、あるいは、ELFN1と類似する膜タンパク質群が多くの薬の標的となっている代謝共役型受容体群を制御するのかどうかについて検討する予定です。 - 2014年7月23日プレス発表
脳には数多くのニューロン(神経細胞)が存在して、複雑なネットワークが形成されています。ニューロンの間にはシナプスと呼ばれる構造があり(下図)
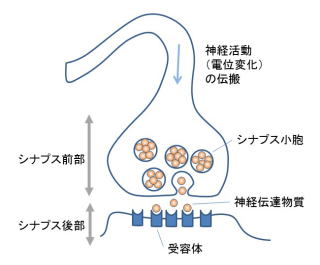
ここで一つのニューロンから神経伝達物質が放出されて、別のニューロンの細胞表面にある受容体に作用することで、情報の受け渡しが行われています。神経伝達物質はシナプスのうちシナプス前部と呼ばれる部分ある小胞に蓄えられていて、他のニューロンを興奮させる作用を持つものと抑制する作用を持つものがあります。このうち、主要な興奮性の神経伝達物質はグルタミン酸です。グルタミン酸受容体はシナプスのうちシナプス後部と呼ばれる細胞表面にあって、イオンの通り道を開閉するもの(イオンチャネル型)と「GTP(結合)タンパク質」というタンパク質を介して、細胞内の酵素の活性を調節するもの(代謝型、GTPタンパク質共役型 *3とも呼ばれる)があります。代謝型のグルタミン酸受容体の一つにmGluR7があり、これは脳に広く分布しているのですが、海馬では錐体細胞という主要な興奮性ニューロンに存在しています。
私たちはシナプスの個性を決める仕組みを調べるために、いまだ機能の分かっていないシナプスの膜タンパク質について研究を進めてきました *4。今回の発見につながったELFN1は抑制性ニューロンで作り出され、抑制性ニューロン上の興奮性シナプス後部に存在しています(下図)。特に海馬にあるOLM細胞、HIPP細胞 *5という抑制性ニューロンに多く存在しています。
シナプスの機能の異常は神経発達障害とよばれる疾患の原因の一つとして注目されており、神経発達障害には自閉症、多動症、知的障害、運動障害などが含まれると考えられています。シナプスの働きを分子レベルから理解することは、これらの疾患を対象とした薬物治療や病態の理解に重要な知見となると期待されています。
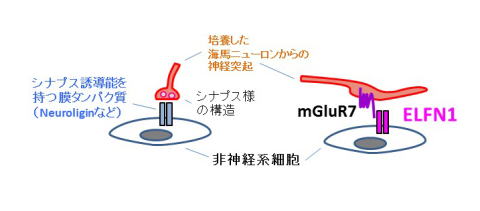
私たちは、はじめにELFN1にシナプスを誘導する活性があるかどうかを調べるため、ELFN1を発現させた非神経細胞をラットの海馬の神経細胞を混ぜ合わせて培養しました。しかし、ELFN1を発現させた細胞に対して、神経細胞がシナプスの様な構造を作る傾向は認められませんでした(下図左)。そこで、ELFN1を発現する海馬のOLM/HIPP細胞に対して作られるシナプスのシナプス前部に存在することが知られているmGluR7の分布を調べたところ、ELFN1を発現する細胞の周囲にmGluR7が集積していることが明らかになりました。非神経系の細胞はmGluR7を産生しておらず、集積したmGluR7はELFN1を産生する細胞に接している神経細胞由来のものと考えられます(下図右)。
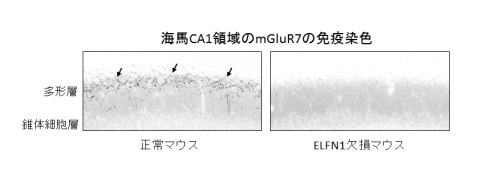
また、ELFN1欠損マウスではOLM細胞の存在する海馬の多形型層にmGluR7の集積が見られません(下図矢印)。
これらの現象を説明するために、ELFN1とmGluR7がお互いに結合する可能性を検討しました。抗体を使ってマウスの脳からELFN1の精製をしたところ、mGluR7も同時に回収され、両者は結合していたと考えられました。また、人工的に作成したELFN1の細胞外領域を含むタンパク質断片を用いた実験からも両者は結合し、ELFN1が神経細胞突起にあるmGluR7を引き寄せるためには両者の結合が必要であることが示されました。これらのELFN1とmGluR7は細胞表面に突き出た部分どうしでお互いに結合するのではないかと考えられました。
そこで、ELFN1欠損マウスから作成した脳スライスを使って、錐体細胞とOLM細胞の間のシナプス伝達の性質を神経細胞の活動によって生じる電位を測定することによって検討してみました。シナプスには活動の程度によってシナプス伝達の効率が長期間に渡って変化する現象(シナプス可塑性)が知られており、記憶や学習の基礎になるのではないかと考えられています。この解析により、ELFN1欠損マウスではこのシナプス可塑性に異常があり、それがmGluR7の存在する前シナプスの性質の変化によるものであることが明らかになりました。
それではELFN1欠損マウスにはどのような行動の変化が表れるのでしょうか。ELFN1欠損マウスを2週間ほどヒトとの接触を断った後、新しい飼育ケースに移動させると、飼育者につかまれるという、その感覚の刺激がきっかけとなって、けいれん発作を起こすことがわかりました(下図左)(ビデオ)。このようなけいれん発作は加齢と共に頻度が増えていくことも明らかになりました。てんかんに似た症状であったので、脳波の異常を検討してみました。すると、異常な振幅を持つ波が頻発しており、脳神経の興奮性の増加が起きている可能性が示されました *6。また、ELFN1欠損マウスには飼育ケージ内をはじめとした様々な行動解析で活動性が高く、周囲の状況に対する警戒が低下している様子が観察されました(下図右)。

ELFN1欠損マウスで見られた現象がてんかんや多動症の患者さんの症状と似ていたので、研究グループはてんかんの患者さんと多動症の患者さんを含む遺伝子材料を用いて、ELFN1の変異探索を行いました。その結果、患者群にのみ認められるミスセンス変異(タンパク質の構造に影響がでる変異)は3種類あり、それが一つの領域に集中していることがわかりました *7。ラット海馬の神経細胞を用いた実験により、これらのミスセンス変異を持つELFN1はmGluR7を引き寄せる活性が下がっていることも明らかになりました(下図)。
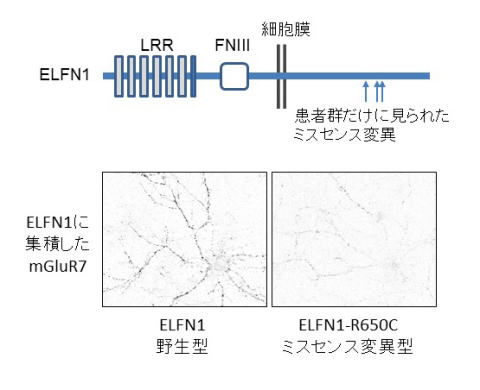
興味深いことに、ELFN1欠損マウスで観察されたのと同じような感覚刺激で誘発されるけいれん発作はmGluR7欠損マウスでも報告されており、ELFN1の機能とmGluR7の機能が密接に関係していることを支持しています。現時点では、てんかん・多動症患者さんから見つかったミスセンス変異がどれくらい多くの患者さんに認められるものなのかについては、十分なデータがありません。しかし、ELFN1とmGluR7の機能異常がこれらの疾患の病態に関係する可能性があるため、研究グループではELFN1の機能を更に解明すると共に、ELFN1と似た構造を持つ膜タンパク質に多くの薬の標的となっている代謝型受容体を制御する活性がないか *8検討する予定です。
この研究は、理研脳科学総合研究センターの富岡直子(現帝京大薬学部)、宮本浩行、守村直子(現立命館大総研)、松本圭史、鈴木俊光、小田川摩耶、小高由梨、岩山佳美、山田一之、吉川武男、山川和弘、群馬大医学系研究科の安田浩樹、韓国延世大学のJi Won Um、Jaewon Ko、静岡てんかん神経医療センターの井上有史、弘前大医学部の兼子直、福岡大医学部の廣瀬伸一の各氏との共同研究として行われました。
*1 ELFN1
ロイシンリッチリピート(LRR)とフィブロネクチン3(FNIII)ドメインを持つ膜タンパク質。2007年にアイルランドの研究グループが報告した(Dolan et al.: The extracellular leucine-rich repeat superfamily; a comparative survey and analysis of evolutionary relationships and expression patterns. BMC Genomics 8, 320. 2007)。本研究チームは脳の膜タンパク質を標的にしたコンピューター解析から、この遺伝子に注目し、解析を続けてきた。アメリカのグループはELFN1が海馬のCA1-抑制性神経細胞のシナプスで神経伝達物質の放出を下げる活性を持つことを見いだしているが、それがどのような分子機構によるものか分かっていなかった(Sylwestrak and Ghosh: ELFN1 regulates target-specific release probability at CA1-Interneuron synapses. Science doi:10.1126/science.1222482, 2012)。
*2 mGluR7 (metabotropic glutamate receptor 7)
代謝型グルタミン酸受容体のグループIIIの一つ。京都大学(現大阪バイオサイエンス研究所)の中西重忠らのグループにより報告された。錐体細胞とOLM細胞の間のシナプスのシナプス前部に存在することが、生理学研究所の重本隆一らにより報告されている(Shigemoto et al.: Target-cell-specific concentration of a metabolotopic glutamate receptor in the presynaptic active zone. Nature 381, 523-525. 1996)。mGluR7欠損マウスおよびmGluR7とその足場タンパク質の一つであるPICK1との結合を障害する変異を持つマウスではけいれん発作が観察されている(Sansig et al.: Increased seizure susceptibility in mice lacking metabotropic glutamate receptor 7. J. Neurosci 21, 8734-8745. 2001; Bertaso et al.: PICK1 uncoupling from mGluR7a causes absence like seizures. Nat Neurosci 11, 940-948. 2008)。
*3 GTPタンパク質共役型受容体(代謝型受容体)
生体内のホルモン、局所ホルモン、神経伝達物質などが作用することが知られている受容体のグループ。一般的に細胞膜を7回貫通し、GTP(結合)蛋白タンパク質を介して、酵素やチャネルの活性を制御することが知られている。生理的に重要な役割をもち、多くの薬の標的タンパク質となっている。代謝型グルタミン酸受容体の一つ、mGluR5に対する薬は実験動物における自閉症様の行動異常を改善することが知られている(Silverman et al.: Negative allosteric modulation of the mGluR5 receptor reduces repetitive behaviors and rescues social deficits in mouse models of autism. Sci Transl Med. 2012 4, 131ra51. doi: 10.1126/scitranslmed.3003501)。
*4 これまでの研究経過
<参考URL>
*5 OLM細胞、HIPP細胞
海馬に存在する抑制性ニューロン。OLM細胞(oriens-lacunosum moleculare細胞)は多形層(stratum oriens)に細胞体があり、ここで錐体細胞からのシナプス入力を受け(ここにELFN1が存在)、分子網状層(stratum lacunosum moleculare)に突起を伸ばし、錐体細胞に対して抑制性のシナプスを形成する(ネガティブフィードバックを形成している)。HIPP細胞(hilar performant path-associated 細胞)は歯状回に細胞体があり、歯状回の興奮性ニューロンである顆粒細胞からのシナプス入力を受け(ここにELFN1が存在)、顆粒細胞の樹状突起に対して抑制性のシナプスを形成している(やはりネガティブフィードバックを形成している)。OLM細胞とHIPP細胞には神経回路における役割に相同性があるが、 発現している分子(ソマトスタチン、ELFN1など)ついても類似点がある。
*6 てんかん、多動症における脳波異常
てんかんは脳の過活動が原因の一つであると考えられている。これまでにナトリウムチャネル、カルシウムチャネルなどの変異が疾患発症に関わる遺伝因子として知られているが、特発性のてんかんの遺伝因子の多くはいまだ不明である。てんかんの患者さんでは脳波異常が認められることが多い。多動症の患者さんの一部でも、脳波異常が認められることが知られており、てんかん・多動症の患者さんの一部の病態には関連するところがあるという説もある。
*7 ELFN1の遺伝子変異探索
この研究では特にタンパク質機能の変化に注目して、健常群および患者群のELFN1のタンパク質コード領域の遺伝子配列解析(re-sequencing analysis)を行っている。変異にはタンパク質の構造に変化を与えるもの(ミスセンス変異、アミノ酸の置換;ナンセンス変異、ストップコドンができる;フレームシフト変異、塩基の欠失挿入によりタンパク質の読み枠がずれる)とタンパク質の構造には変化が及ばないもの(サイレント変異)がある。
*8 代謝型受容体のトランス制御
これまでの研究では代謝型受容体(GTPタンパク質共役型受容体)の機能についてはリガンド(ホルモン、局所ホルモン、神経伝達物質、投与された薬)などによるものが知られている。ELFN1のように別の細胞に存在する膜タンパク質によって代謝型受容体が制御されることを研究チームは「トランス制御」と呼んでいる。他の代謝型受容体へもトランス制御が行われるかどうかは代謝型受容体を標的にした創薬にとっても重要な知見となるのではないかと考えられる。


