SLITRK6は近視と難聴の合併症の原因遺伝子である
(Tekin et al., 2013)
近視は、世界中で最も頻度の高い視覚障害の原因の1つで、特にアジアの都市部では発症頻度が70%を超えるという報告もあります(文献1)。このうち重度の近視は約1~3%で見られ、網膜剥離、黄斑変性症、白内障、緑内障などを合併しやすいことも知られています。
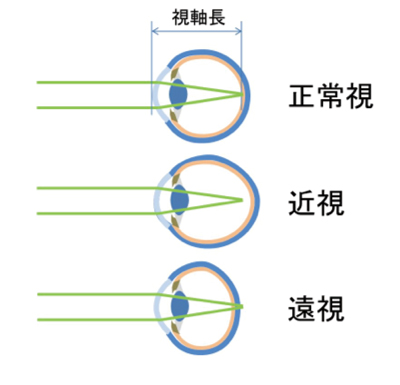
近視は、外界からの光が網膜より前で焦点を結んでしまうことで起きます。眼球が奥行き方向に長いため起きる「軸性近視」と、角膜や水晶体の屈折率が強すぎるため起きる「屈折性近視」とに分けられます。一般に近視と呼ぶものは軸性近視を指します。
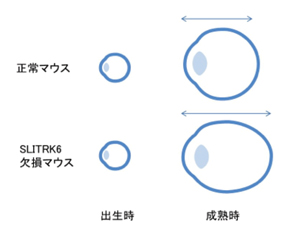
眼球は生後の成長過程で大きくなり、それに伴って視軸長も伸びます。視軸長が長すぎると「近視」、短すぎると「遠視」、適正範囲だと「正常視」となります(図1)。
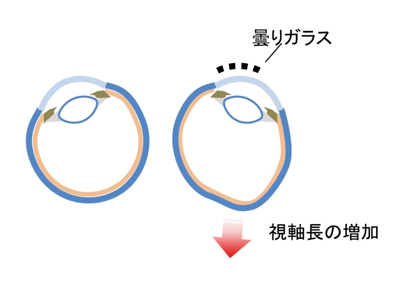
これまでのサルを用いた研究により、出生直後に片目の光を遮ると、その眼が近視様の変化(視軸長の伸長)を示すことから(図2、文献2)、網膜が受容する光情報が視軸長の調節に関わると考えられていますが、具体的なメカニズムは分かっていません。
近視の発症には、遺伝子が大きく関与すると考えられ、多くの研究者により原因遺伝子の探索がされてきました。しかし、患者共通の原因遺伝子はほとんど発見されなかったため、近視発症に数多くの遺伝子が複合的に関与していると推察されていました。
近視と同様に発症頻度が高い難聴も、その発症には遺伝子の関与が大きいと考えられています。出生時の罹患率はおよそ0.1%程度で9才までに倍加するという報告があります(文献3)。また、ある遺伝子の変異が全身の系統的な異常を引き起こし、近視と先天性の難聴が合併して現れる症例も数多くあります。例えば、結合組織をつくるコラーゲンの代謝に関連する一部の遺伝子に変異が起きると軟骨の形成異常に伴って、骨や関節の形成異常と共に近視と難聴が認められます。そこで私たちは、近視と難聴を合併して発症する家系を対象に、その原因遺伝子の探索解析に挑みました。
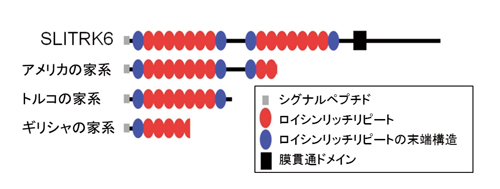
共同研究者の英国ロンドン大学のアンドルー クロスビー博士らは、米国の家系を対象に「ホモ接合体マッピング」※1で、また米国マイアミ大学のムスタファ テキン博士らはトルコ人、ギリシャ人の家系を対象とした「エキソームシーケンシング」※2で、網羅的に遺伝子変異を探索しました。その結果、いずれもSLITRKファミリー※3の一つ「SLITRK6タンパク質」をコードする遺伝子に変異があり、産生されるSLITRK6タンパク質には膜貫通ドメインが失われていました(図3)。SLITRK6タンパク質は、視床や内耳などで産生されること、シナプス形成、神経突起の伸長制御に役割を持つことなどが知られています。
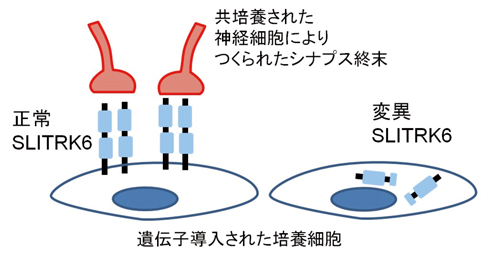
そこで、理研の行動発達障害研究チームは、発見した変異SLITRK6遺伝子がコードする変異SLITRK6タンパク質の機能を検討しました。その結果、正常なSLITRK6タンパク質は細胞膜表面で検出されますが、3家系から得られた異なる3種類の変異SLITRK6タンパク質はいずれも細胞膜表面では検出されず、「シナプス形成を促進する能力」(SLITRKファミリーのシナプス形成能)と「神経突起の伸展を制御する能力」を両方とも失っていることが分かりました(図4)。これらの結果からSLITRK6タンパク質の機能喪失が、近視や難聴を引き起こすのではないかと推測しました。
2009年に私たちは、SLITRK6タンパク質を欠損するマウスが内耳の神経回路形成に異常をきたし、難聴を示すことをすでに報告していました。そこで今回は、SLITRK6タンパク質欠損マウスが近視の症状を示すか検討しました。具体的には、欠損マウスの視軸長を測定するために造影剤を点眼し、MRI装置で解析しました。その結果、出生時の視軸長には全く差が認められませんでしたが、成熟時(10-12カ月齢)では正常マウスに比べSLITRK6タンパク質欠損マウスの視軸長が3.2%長くなっており(図5)、視軸長の伸長異常は生後の成長過程で起きたと分かりました。また、生後の成長過程では、SLITRK6遺伝子が網膜で発現していることも明らかになりました。
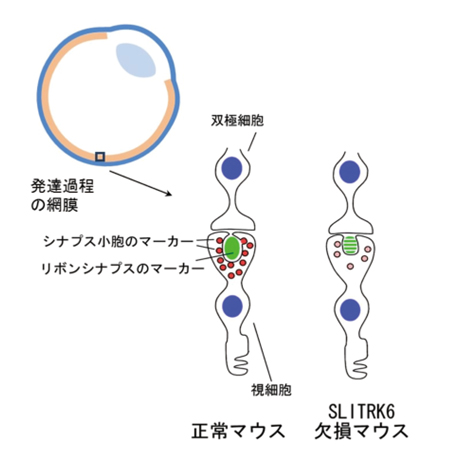
次に、SLITRK6タンパク質欠損マウスの詳細な網膜発達を検討するため、網膜を構成する各神経細胞のシナプスや神経突起を示すマーカー分布を調べました。その結果、「リボンシナプス」※4と呼ばれる特殊な構造を持つシナプスを示すマーカーの出現が、正常マウスに比べて遅れていました。この遅れは、マウスの眼が開き光刺激を受けて反応し始める生後10日前後に最も大きくなりました。これらの結果から、SLITRK6タンパク質は、網膜内での神経回路形成を調節し、その機能が正常視の成り立ちに必要と分かりました(図6)。
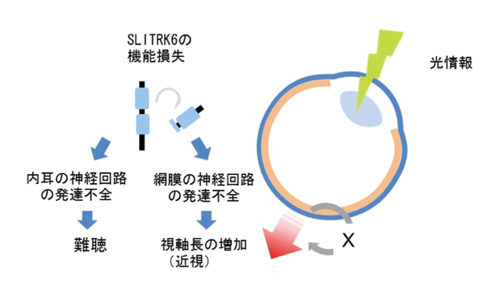
以上から、SLITRK6タンパク質の機能喪失が、近視と難聴の合併症を引き起こすことが明らかになりました。リボンシナプスは、網膜の他に内耳に存在することが知られています。今回の成果から、内耳のシナプス発達過程でも、SLITRK6タンパク質は似た役割を担っている可能性が示唆されます。今後、理研の行動発達障害研究チームは、SLITRK6タンパク質欠損マウスの内耳のリボンシナプス形成の時期にも異常があるかどうかを検討する予定です。特に、SLITRK6タンパク質がどのような分子を介して神経回路網の発達過程に関わるのか(図7のX)を、その謎の解明を目指します。これらの点が解明されると、正常な視覚や聴覚の発達に対する理解が深まると同時に、近視や難聴の発症メカニズムのさらなる理解と新たな治療法開発に役立つと期待できます。
補足説明
*1 ホモ接合体マッピング
近親婚の家系の解析から、劣性遺伝疾患の原因遺伝子を染色体上で同定する手法。
*2 エキソームシーケンシング
全ゲノムのうち、1%を占めるタンパク質コード領域の塩基配列を決定する手法。タンパク質コード領域には機能的に重要な情報が含まれ、全ゲノム解析と比較して、安価で効率的な解析が期待できる。
*3 SLITRKファミリー
神経系細胞に発現する新規の細胞膜貫通型タンパク質ファミリーとして、2003年理研脳科学総合研究センターの発生発達研究グループが発見した。1回膜貫通型タンパク質で、アミノ末端側にはロイシンリッチリピートというタンパク質-タンパク質間の結合によく用いられるドメインが2個存在し、カルボキシ末端側には神経栄養因子受容体と部分的に類似のアミノ酸配列が存在する。6種類の細胞膜貫通型タンパク質からなるSLITRK1~SLITRK6が脳神経系に広く発現する。これらのタンパク質は神経突起の伸展制御とシナプス形成促進の機能を持つ。
*4 リボンシナプス
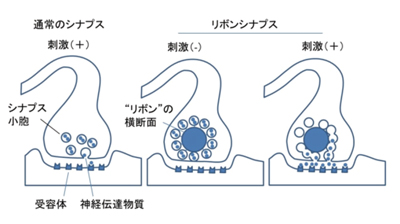
神経伝達物質を放出する部位にできるリボンと呼ばれる索状の構造を持つシナプスで、常時多数のシナプス小胞が係留されているため、強弱の差の大きな外界からの情報を恒常的に受け取ることができると考えられている(下図)。
文献
- Lin et al., Ann Acad Med Singapore 33: 27-33. 2004
- Earl Smith et al., Investigative Ophthalmology & Visual Science, 46:3965-3972. 2005
- Ardle,B.M. and Bitner-Glindzicz,M.Arch Dis Child Educ Pract Ed 95:14-23. 2010


